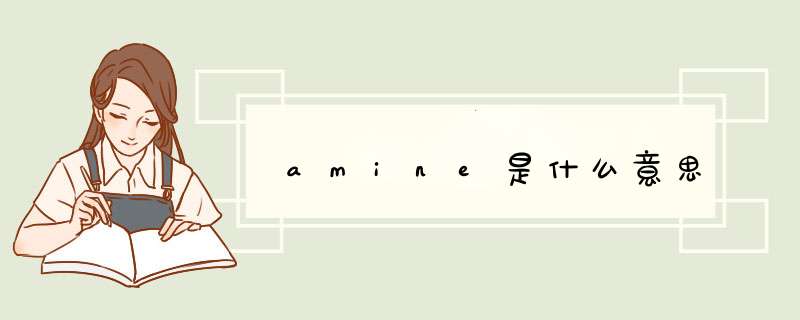
求氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙的全部元素符号

氢(H) 氦(He) 锂(Li) 铍(Be) 硼(B)碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne)钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P)硫(S) 氯(Cl) 氩(Ar) 钾(K) 钙(Ca)
扩展资料:
符号歌
元素符号有来由, 拉丁名称取字头;
第一个字母要大写, 附加字母小写后。
对比碳C,铜Cu N氮、P磷、S硫;
Si硅、氧是O, 铝Al、铅Pb;
Ba钡、钨W, Ag是银、Zn锌;
I碘、K钾、Br溴, H是氢、U是铀;
Fe铁、Na钠, Mg镁、Ca钙;
Hg汞、金Au, Sn锡、Sb锑;
氯Cl、钴Co, 元素符号要熟记。
碳是C,磷是P, 铅的符号是Pb。
Cu铜,Ca钙, 钨的符号W。
H氢,S硫, 硅的符号Si。
金Au, 镁的符号Mg。
钠Na,氖Ne, 汞的符号Hg。
硼是B,钡Ba, 铁的符号Fe。
锌Zn,锰Mn, 锡的符号Sn。
钾是K,碘是I, 氟的符号是F。
氧是O,氮是N, 溴的符号是Br。
Al铝,Cl氯, 锑的符号Sb。
参考资料:
氮气瓶颜色为黑色,字样“氮”,字颜色为淡黄。
当压力为20Mpa,为白色环一道,当压力为30Mpa,为白色环二道氮气瓶是黑色,氢气瓶是深绿色的。《气瓶颜色》(GB 7144-1999)对气瓶颜色作了明确规定。例如:乙炔气瓶为白色、氮气瓶为黑色、氧气瓶为淡蓝色、氨气瓶为淡**、二氧化碳气瓶为铝白色,氢气瓶为深绿色。
氮气注意事项
空气中氮气含量过高,使吸入气氧分压下降,引起缺氧窒息。吸入氮气浓度不太高时,患者最初感胸闷、气短、疲软无力。
继而有烦躁不安、极度兴奋、乱跑、叫喊、神情恍惚、步态不稳,称之为“氮酩酊”,可进入昏睡或昏迷状态。吸入高浓度,患者可迅速昏迷、因呼吸和心跳停止而死亡。
qīng氢,hài氦,lǐ锂,pí铍,péng硼。tàn碳,dàn氮,yǎng氧,fú氟,nǎi氖,nà钠,měi镁,lǚ铝,guī硅,lín磷,liú硫,lǜ氯,yà氩,jiǎ钾,gài钙。
氦 hài:一种气体元素,无色、无臭,可用来填充灯泡和霓虹灯管,亦用来制造泡沫塑料。液态氦常用做冷却剂。
硼péng:约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。法国化学家盖·吕萨克用金属钾还原硼酸制得单质硼。
钙 gài:长时期里,化学家们将从含碳酸钙的石灰石焙烧获得的钙的氧化物当作是不可再分割的物质。在1789年拉瓦锡发表的元素表中就列有它。
硫liú:硫(sulfur)是一种非金属元素,化学符号S,原子序数16。硫是氧族元素(ⅥA族)之一,在元素周期表中位于第三周期。
铝lǚ:银白色轻金属。有延展性。铝粉在空气中加热能猛烈燃烧,并发出眩目的白色火焰。易溶于稀硫酸、硝酸、盐酸、氢氧化钠和氢氧化钾溶液,难溶于水。
氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙的化学式:氢(H),氦(He),锂(Li),铍(Be),硼(B)碳(C),氮(N),氧(O),氟(F),氖(Ne)。钠(Na),镁(Mg),铝(Al),硅(Si),磷(P)。硫(S),氯(Cl),氩(Ar),钾(K),钙(Ca)。
氮的五笔简码是:RNO
氮的五笔全码是:RNOO
氮的五笔拆分图解:
汉字:氮
拼音:dàn
部首:气
笔画:12
基本释义:
氮是一种化学元素,它的化学符号是N,它的原子序数是7。氮是空气中最多的元素,在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的基本元素之一。
氮及其化合物在生产生活中应用广泛。
如氮肥、氮气。
氮的固定是指将空气中游离态的氮转化为含氮化合物的过程。
一、释义
氮的固定是指将空气中游离态的氮转化为含氮化合物的过程。这种转化可以通过自然或人工的方式进行。例如,豆类植物与根瘤菌共生,它们能吸收大气中的氮气分子,将其转变成氨及铵离子,这就是一种自然的氮固定。
二、氮的固定的作用
氮的固定是将空气中游离态的氮转化为含氮化合物的过程,这个过程对于植物的生长和发育具有重要意义。植物通过吸收这些含氮化合物来合成其所需要的蛋白质、核酸等生物大分子,促进植物的生长和发育。
氮的固定也为动物提供了食物来源。植物通过吸收大气中的氮气而合成的大量含氮化合物,会被动物进一步利用合成其自身的组织器官,从而为动物的生存提供了重要的营养来源。
氮的固定如何进行的:
一、闪电
闪电以其巨大的能量,把在大气中的氮分子解离,并继续与氧分子反应产生氮的氧化物,这些氧化物会溶于雨水,生成亚硝酸根及硝酸根而渗入土壤中。
虽然世界上到处常有闪电,但是闪电固氮却不是一个产生含氮化合物有效的方法,每年经由闪电固氮所得的含氮化合物,顶多只占总量的10%。
二、固氮细菌
这是固定氮的最重要途径,须借助于或独自存在于土壤中,或与动植物共生,拥有固氮酵素的某些固氮细菌,如与豆类植物共生的根瘤菌。
它们能吸收大气中的氮气分子,将其转变成氨及铵离子。每年经由细菌固定氮所得的含氮化合物,约占总量的65%。还有一些植物也具有固氮的能力,例如豆类植物和禾本科植物。这些植物通过与固氮细菌共生或通过自身固氮酶的作用,可以将大气中的氮气转化为含氮化合物。
氮5离子的电子式如下图。
为了简便起见,化学中常在元素符号周围用黑点“”和叉“×”来表示元素原子的最外层电子。这种表示的物质的式子叫做电子式。
但是,中学所学习的经典的8隅体的电子式属于过时的理论,只能用于表示很少一部分由主族元素形成的物质,不能表示由过渡元素形成的物质,亦不能正确表示多种常见物质的结构。
用电子式可以表示原子、离子、单质分子,也可表示共价化合物、离子化合物及其形成过程。
依据元素的原子最外层电子个数的多少,先用小黑点“·”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对。
扩展资料:
书写电子式注意事项
1、无论何种微粒,其电子式都是由原子为基本单位组成的,不能出现角码甚至系数。
2、组成各种微粒的各个原子的电子式,必须力求均匀、对称。稳定的8电子结构通常表示为四对电子(一般为元素符号的上、下、左、右各一对电子)。
3、中学所学习的经典的8隅体的电子式属于过时的理论,只能用于表示很少一部分由主族元素形成的物质,不能表示由过渡元素形成的物质。
-电子式
NO₂的空间构型为V型(折线形)
NO₂的孤电子对=(5-22)/2=05
计算出来的孤电子对不是整数,这时应当作1来对待,因为,单电子也要占据一个孤对电子轨道。
综上所述 NO2的价层电子对=2+1
所以NO₂的VSEPR模型为平面三角形
NO₂的空间构型为V型(折线形)
二氧化氮是大π键结构的典型分子。大π键含有四个电子,其中两个进入成键π轨道,两个进入非键轨道。二氧化氮分子是V形分子、极性分子。
判断NO₂分子的结构
在NO₂分子中,N周围的价电子数为5,根据价层电子对互斥理论(VSEPR理论),氧原子不提供电子,因此,中心氮原子的价电子总数为5,相当于三对电子对。
其中有两对是成键电子对,一个成单电子当作一对孤电子对。氮原子价层电子对排布应为平面三角形。所以NO2分子的结构为V字形,O-N-O键角约为120度。
扩展资料:
分子中的原子是由共价键(包括单键、双键、叁键等)或/和离子键连结起来的,因此分子形状可通过键长、键角和二面角这些参数来阐明。
键长被定义为任何分子中,两个原子中心间的平均距离;键角是相邻三个原子两条键之间的夹角;而二面角,或称扭转角,则相对于四个相邻原子而言,是前三个原子所形成的平面与剩下一根键之间所成的角度。
二氧化氮溶于水并与水反应生成硝酸或硝酸和一氧化氮。但二氧化氮溶于水后并不会完全反应所以会有少量二氧化氮分子存在,为**。由于硝酸同时会分解,所以可以看作可逆反应。因二氧化氮溶于水后还生成一氧化氮,所以不是硝酸的酸酐。
二氧化氮可以直接被过氧化钠吸收,生成硝酸钠:
其他复分解反应:也可以被氢氧化钠吸收(发生的是歧化反应):
若和一氧化氮一起被吸收,则发生归中反应:
和金属氧化物可以发生反应生成无水硝酸盐和一氧化氮:
——二氧化氮
——分子结构
求氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙的全部元素符号
本文2023-10-18 11:54:57发表“古籍资讯”栏目。
本文链接:https://www.yizhai.net/article/144368.html